calor é a energia térmica em trânsito, entre dois corpos ou sistemas, decorrentes apenas da existência de uma diferença de temperatura entre eles.
Unidades
No S.I. o calor é medido em J (joule). Usualmente utiliza-se a cal (caloria), tal que:
1 cal = 4,186 J
Sinal do Calor O calor (quantidade de energia térmica) é positivo (Q > 0) quando um corpo recebe energia térmica, e negativa (Q < 0) quando perde. Calor perdido Q < 0
Calor recebido Q > 0
Formas de Calor A quantidade de energia térmica recebida ou perdida por um corpo pode provocar uma variação de temperatura ou uma mudança de fase (estado de agregação molecular).
O calor responsável pela variação de temperatura recebe o nome de calor sensível, já o calor responsável pela mudança de fase, recebe o nome de calor latente.
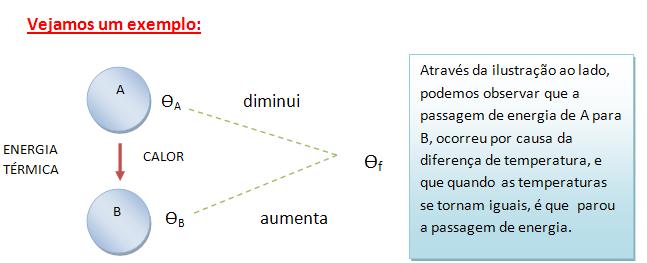
Colocando dois corpos, de temperaturas diferentes (quente e frio) em contato, percebe-se que a temperatura do corpo mais quente diminui, enquanto que a temperatura do corpo mais frio aumenta. Após certo tempo, as temperaturas dos dois corpos igualam-se. Nesse momento, o fluxo de calor é interrompido, e diz-se que os corpos se encontram em equilíbrio térmico.
É importante diferenciar calor de temperatura, pois são grandezas físicas diferentes: temperatura é a medida do nível de energia interna de um corpo; calor é a passagem de energia de um corpo para outro, devido à diferença de temperatura entre eles.
Fórmula Fundamental da Calorimetria
Consideremos um corpo de massa m à temperatura inicial t1.
Fornecendo-se uma quantidade de calor Q a esse corpo, suponha que sua temperatura aumente até tf.
experiência mostra que a quantidade de calor Q é proporcional à massa m e à variação de temperatura (tf – ti). Logo:
Q = mc(tf – ti) ou Q = mct
Temos:
c = calor específico da substância;
t= tf - ti = variação de temperatura.
Observações:
1. Se tf > ti o corpo recebe calor, isto é, Q > 0; se tf < ti o corpo cede calor, isto é, Q < 0.
2. O produto m.c é a capacidade térmica do corpo.
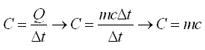
Aplicações
01. Um bloco de ferro com massa de 600g está a uma temperatura de 20ºC. O calor específico do ferro é igual a 0,114cal/g.ºC.
a) Qual a quantidade de calor que o bloco deve receber para que sua temperatura passe de 20ºC a 50ºC?
b) Qual a quantidade de calor que o bloco deve ceder para que sua temperatura varie de 20ºC a –5ºC.
Solução:
a) Dados: m = 600g; ti = 20ºC; c = 0,114cal/g.ºC; tf = 50ºC
Q = mc(tf – ti) Q = 600 . 0,114 . (50 - 20)
Q = 2 052cal
b) Q = mc(tf – ti) Q = 600 . 0,114 . (-5 - 20)
Q = -1 710cal
02. Sob uma chama constante, de potência 192,5W, um corpo sofre um aumento de temperatura de 40°C em 2min. Determine, em cal/°C, a capacidade térmica desse corpo. Considere 1cal = 4,2J.
Solução:
A quantidade de calor fornecida ao corpo pela chama é:
OBS: A unidade de capacidade térmica pode ser tanto em cal/°C (caloria/grau celsius), como em J/K (joule/kelvin).
Calor Latente
O comportamento das substâncias durante as mudanças de fases pode ser interpretado por meio dos seguintes fatos:
1º fato: Para passar da fase líquida para a fase sólida, 1g de água precisa perder 80cal. Do mesmo modo, para derreter, 1g de gelo precisa ganhar 80cal.
Note que 80cal representam a quantidade de calor que a água ganha ou perde quando se derrete ou se congela, quando está a 0°C.
2º fato: Se a água está a 100°C, cada grama precisa de 540cal para passar à fase gasosa, e cada grama de vapor precisa perder 540cal para passar à fase líquida.
Outras substâncias também possuem valores fixos de quantidade de calor que 1g da substância precisa ganhar ou perder para mudar de uma fase para outra. Essa quantidade de calor é denominada calor latente e é indicada pela letra L.
O calor latente provoca unicamente uma mudança de fase do corpo, sem alterar sua temperatura. Vejamos a função:
Temos que L é o calor latente em cal/g.
Usaremos:
Lf para calor latente de fusão;
Lv para calor latente de vaporização;
Ls para calor latente de solidificação;
Lc para calor latente de condensação.
Em nosso curso, adotaremos: Calor latente de fusão do gelo (a 0°C):
Lf = 80 cal/g.
Calor latente de solidificação da água (a 0°C):
Ls = – 80 cal/g.
Calor latente de vaporização da água (a 100°C):
Lv = 540 cal/g.
Calor latente de condensação do vapor (a 100°C):
Lc = – 540 cal/g.
Aplicações
0 1. Um bloco de gelo de massa 600g encontra-se a 0°C. Determine a quantidade de calor que se deve fornecer a essa massa para que ela se transforme totalmente em água a 0°C. Dado: Lf = 80cal/g.
Solução
A quantidade de calor que devemos fornecer ao bloco de gelo é para que ele se transforme totalmente em água a 0ºC; logo:
Q = mLf →600. 80 →Q = 48000 cal = 48kcal
02. Um bloco de alumínio de 500g está a uma temperatura de 80°C. Determine a massa de gelo a 0°C que é preciso colocar em contato com o alumínio para se obter um sistema alumínio-água a 0°C.
Dados: calor específico do alumínio=0,21cal/g.°C; calor latente de fusão do gelo = 80cal/g
Solução:
A massa do gelo que se funde provoca a diminuição até 0 ºC do bloco de alumínio, logo:
Qgelo + Qaluminio = 0→ m1Lf + m2c(tf – ti) = 0
m1 . 80 + 500 . 0,21 . (0 – 80) = 0→ m1 = 105g
Balanço energético
Vejamos vários corpos com diferentes temperaturas, onde não há trocas de calor com o meio externo, tornando-se assim um sistema isolado. Pelo fato das temperaturas serem diferentes, podemos afirmar que eles trocam calor entre si, até chegarem ao equilíbrio térmico.
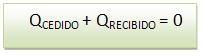
Por apresentar um sistema isolado, sua energia térmica total permanece constante, fazendo com que, tanto a soma da quantidade de calor cedida pelos corpos mais quentes, como a quantidade de calor recebida, pelos corpos mais frios, sejam iguais.
Veja:
Porém se o calor recebido for Q>0, e o calor cedido for Q<0, a expressão será:
Exemplo:
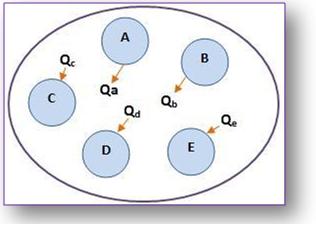
Qa + Qb + Qc + Qd + Qe = 0
O raciocínio feito acima estabelece o principio da igualdade das quantidades de calor trocadas, que pode ser expresso da seguinte maneira:
“Quando dois ou mais corpos, em temperaturas diferentes, são postos em contato, constituindo um sistema termicamente isolado, eles trocam calor até atingir o equilíbrio térmico”.
Equivalente em água O equivalente em água de um sistema é dado como a massa de água que tem a mesma capacidade térmica do sistema considerado.
Podemos considerar E o equivalente em água de um determinado sistema, e com isso temos:
Csistema = Cequiv. em água.
ou seja
Csistema = E . cágua
Processos de transmissão de calor
1) Condução
Ex.: aquecimento de uma colher de metal.
Processo de transmissão de calor no qual a energia é passada de partícula para partícula. Uma partícula com temperatura maior (mais agitada) transfere energia para a partícula vizinha que passa a vibrar mais intensamente; esta energia para outra partícula, que transfere para outra, e assim sucessivamente. A condução de calor exige um meio material, logo, não pode ser no vácuo.
2) Convecção
A convecção é o processo de transmissão de energia que se dá através de movimentação de massa fluidas. Não é possível ocorrer convecção no vácuo. Pode ocorrer com líquidos e gases.
Ex.: aquecimento de água.
3) Radiação (ou Irradiação)
Processo de transmissão de calor através ondas eletromagnéticas (ondas de calor). Trata-se da única forma de propagação de calor que pode ocorrer tanto no vácuo quanto em outros meios. Alguns materiais não permitem propagação de calor, os chamados atérmicos (parede de tijolo). Já os meios que permitem a radiação são chamados diatérmicos.
Ex.: energia solar, que se propaga no vácuo até atingir a atmosfera e chegar até nós.
Garrafa Térmica
A tampa impede a convecção. A parede dupla de vidro impede a condução (o vidro é mau condutor) e a convecção. O vácuo entre as paredes de vidro impede a condução. O vidro espelhado impede a radiação.
Obs.:
- Em certos dias, verifica-se o fenômeno de inversão térmica, que causa aumento de poluição, pelo de a atmosfera apresentar maior estabilidade. Esta ocorrência é devida ao seguinte fato: as camadas superiores de ar atmosférico têm temperatura superior à das camadas inferiores.
- Para entrar num forno quente, deve-se entrar com uma roupa de lã recoberta de alumínio.
- Os iglus, embora feitos de gelo, possibilitam aos esquimós neles residirem porque o gelo não é um bom condutor de calor.
- Nas fábricas onde existem grandes fornos, são colocadas chaminés bem altas. A principal função dessas chaminés é conseguir maior renovação do ar na fornalha, por convecção.


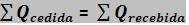


Nenhum comentário:
Postar um comentário