Modelo dos gases ideais
O modelo dos gases ideais é uma aproximação bastante simplificada do comportamento dos gases. As relações entre as variáveis são dadas apenas por relações proporcionais diretas e inversas. As propriedades básicas de um gás são pressão, volume, massa e temperatura.
Se fixarmos duas das propriedades, podemos determinar uma relação entre as outras duas. Estas relações foram estudadas e a prática demonstrou que se a pressão e temperatura forem constantes, o volume de um gás depende de sua massa (quantidade de móis). Se massa e temperatura forem mantidas constantes, a multiplicação da pressão e do volume resulta em um valor aproximadamente constante. Esta última relação é conhecida como Lei de Boyle, em homanagem a Robert Boyle que a observou em 1660. Ainda, se massa e pressão forem mantidas constantes, o volume será diretamente proporcional à temperatura, e esta relação foi observada por Charles e Gay-Lussac.
Podemos esquematizar as informações acima da seguinte forma:Estas relações podem ser representadas nos gráficos abaixo
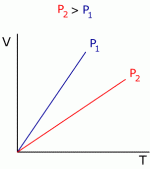
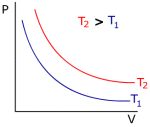
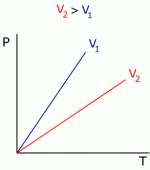
Gráfico 1 Gráfico 2 Gráfico 3
Reunindo estas informações podemos montar uma equação simples e elegante
Na equação acima é possível perceber a existência da constante R, que é chamada de constante universal dos gases. O valor desta constante é apresentado abaixo em várias unidades.
| R= | 0,082057 L.atm.K-1. mol-1 |
| 8,31451 J.K-1.mol-1 | |
| 1,9872 cal.K-1.mol-1 | |
| 8,31451.102 L.bar.K-1.mol -1 | |
| 82,057 cm3.atm.K-1.mol-1 | |
| 62,36 L.torr.K.mol-1 |
Em todos os casos a constante é apresentada em relação ao Kelvin, por isso devemos tomar o cuidado de ao trabalhar com gases ideais de sempre fazer a conversão adequada de escala de temperatura.
Observando o Gráfico 1, é possível constatar que para temperaturas muito baixas o volume do gás diminui até encontrar o valor zero. É óbvio que não é possível existir um volume zero para um gás, então este é um dos motivos pelo qual a equação dos gases ideais falha para condições muito severas, como baixas temperaturas e altas pressões. Para casos mais extremos e de maior precisão devemos utilizar modelos de gases reais.
Observando o Gráfico 1, é possível constatar que para temperaturas muito baixas o volume do gás diminui até encontrar o valor zero. É óbvio que não é possível existir um volume zero para um gás, então este é um dos motivos pelo qual a equação dos gases ideais falha para condições muito severas, como baixas temperaturas e altas pressões. Para casos mais extremos e de maior precisão devemos utilizar modelos de gases reais.


Nenhum comentário:
Postar um comentário